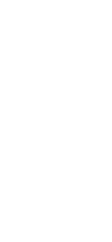
ドナー様及び患者様の血液から、アフェレーシス法によりT細胞(リンパ球の一種)を採取します。ドナー様及び患者様、それぞれのT細胞と抗ヒトCD80/CD86抗体とで共培養することで、ドナー様から移植された臓器の組織を患者様の生体が拒絶反応しない細胞として誘導型抑制性T細胞(JB-101)が作製していきます。
※アフェレーシス法
体外循環によって血液中から血漿成分、細胞成分を分離する。
ドナー様及び患者様の血液から、アフェレーシス法によりT細胞(リンパ球の一種)を採取します。ドナー様及び患者様、それぞれのT細胞と抗ヒトCD80/CD86抗体とで共培養することで、ドナー様から移植された臓器の組織を患者様の生体が拒絶反応しない細胞として誘導型抑制性T細胞(JB-101)が作製していきます。
※免疫寛容
免疫抑制剤から離脱(免疫抑制剤を使わない)。
誘導型抑制性T細胞(JB-101)は、患者様が臓器移植された後に投与致します。投与後は、患者様の安全を確認しながら徐々に免疫抑制剤の量を減らしていきます。この間は、患者様の生体内で拒絶反応が潜在的に起きていないかをモニタリングしていきます。最終的には、免疫抑制剤の投与を中止できた時に免疫寛容となります。
※抗原
外から(自身の生体外)から入ってくる組織、細菌、ウイルスなど。
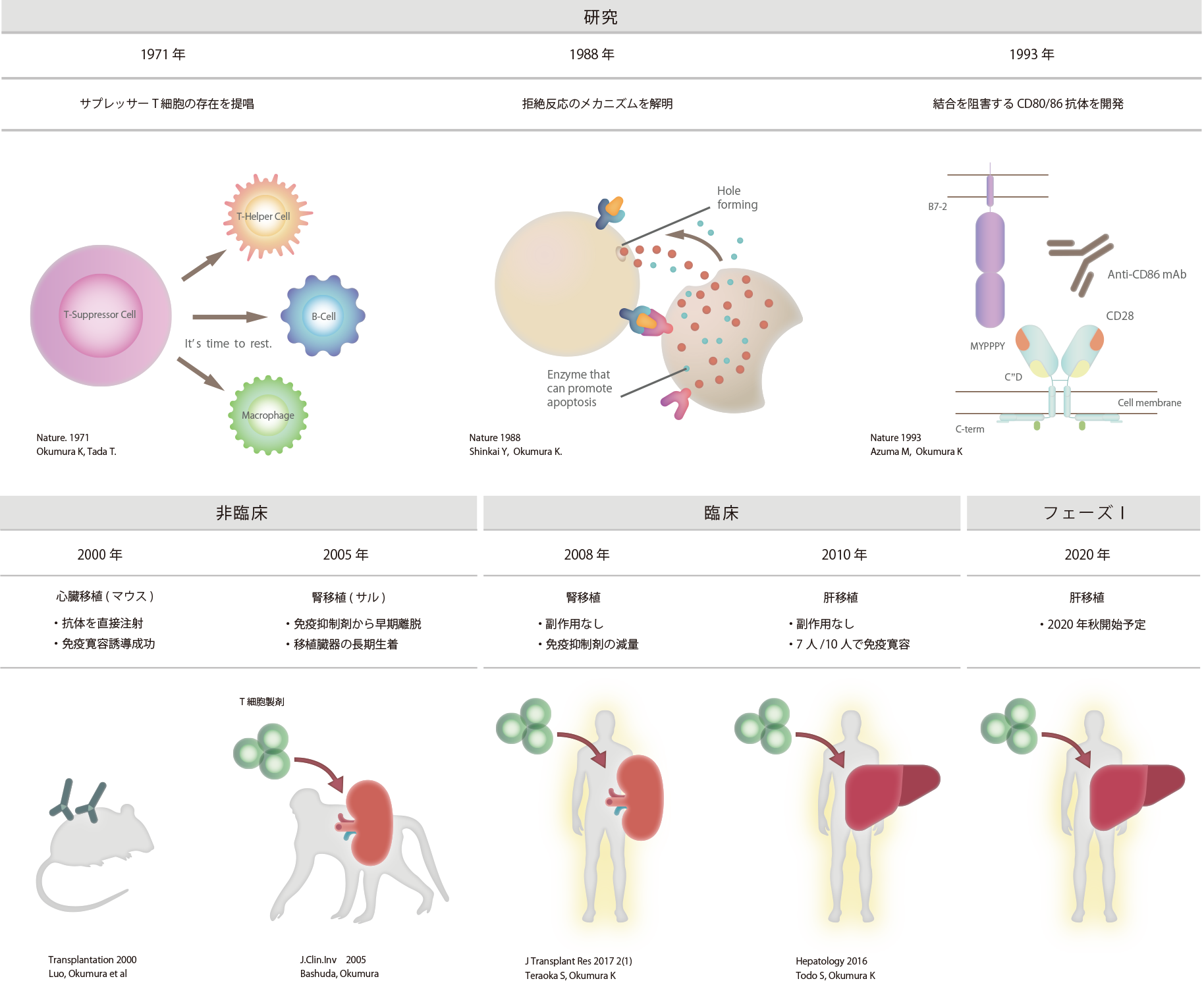
1971年に順天堂大学の奥村 康 特任教授が免疫を抑制する細胞であるサプレッサーT細胞を発見されてから、順天堂大学の研究グループが生体内の免疫拒絶反応のメカニズムを解明の研究を進めてきた結果、誘導型抑制性T細胞の作製に成功しました。
その後、最も過剰免疫反応である臓器移植の拒絶に着目して、マウス、サルの非臨床試験などを経て、
2016年には北海道大学の臨床研究において誘導型抑制性T細胞による生体肝移植手術を実施し、
10名中7名の肝移植患者様が免疫抑制剤から完全に離脱(免疫抑制剤を使わない)することに成功をいたしました。
当社は、順天堂大学の研究グループの研究成果を実用化・医薬品化するために設立し、
臓器移植から過剰免疫反応による難治性疾患の研究へと展開していくことを目指しています。

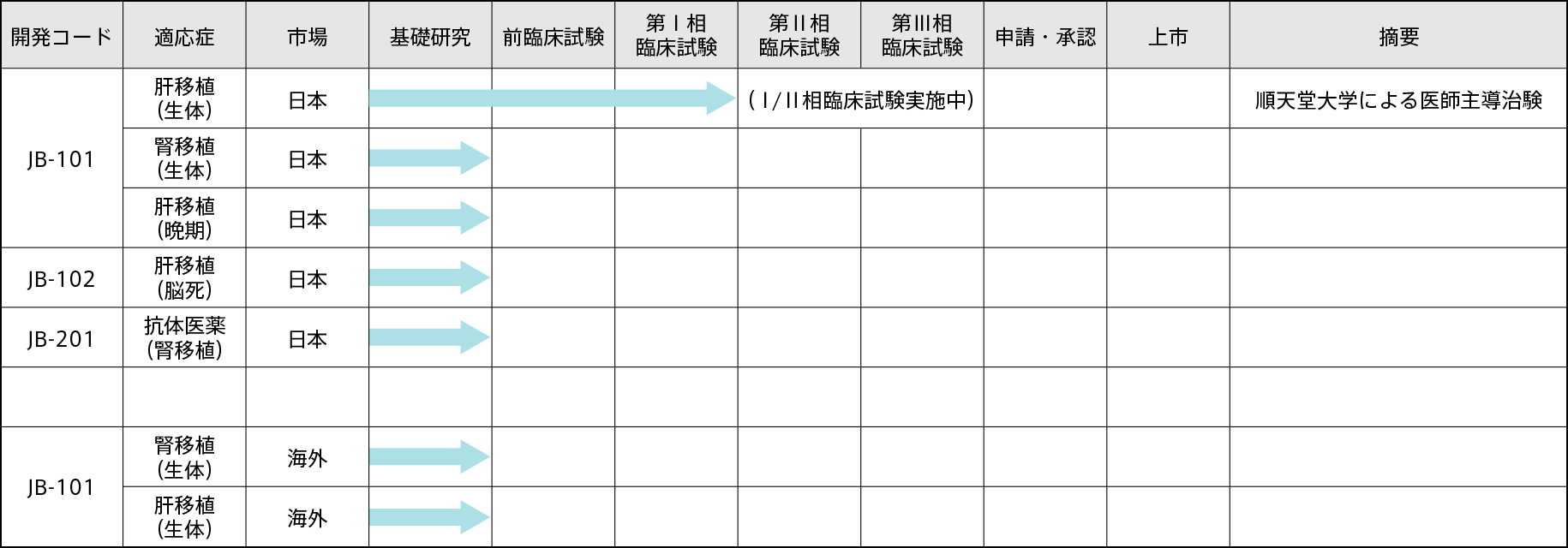
開発予定テーマ
誘導型抑制性T細胞(JB-101)は、2020年6月に厚生労働省「先駆け審査指定制度」の対象品目に指定されております。
2020年度7月に順天堂大学が「生体肝移植における誘導型抑制性T細胞(JB-101)による免疫寛容誘導能及び安全性を評価するⅠ/Ⅱ相臨床試験」の治験届を独立行政法人医薬品医療機器総合機構(PMDA)に提出し「免疫抑制剤の要らない肝移植を普及させるため」の医師主導治験を開始いたしました。
今後は、下記の開発予定テーマ表のとおり、適応症の拡大及び海外での治験を順次推進して参ります。